雄激素受体信号通路(androgen receptor pathway)是前列腺癌(prostate cancer,简称PCa)发生发展中的关键因素。靶向拮抗AR信号通路的雄激素剥夺疗法(androgen deprivation therapy, 简称ADT)是临床上最为经典的治疗手段之一,然而多数患者在短期疾病缓解后会出现治疗抵抗并且复发成去势抵抗性前列腺癌(castration-resistance prostate cancer, 简称CRPC)。CRPC预后差,致死率高,是一种复杂的异质性肿瘤,各个肿瘤组织之间具有不同的AR信号通路活化程度。
随着研究的不断深入,AR+CRPC相关分子特征已日渐明确,但人们对AR- CRPC的发病机理或干预AR- CRPC进展的治疗方法仍有待阐明。尽管不断面世的二代抗雄药可以减缓部分CRPC患者疾病进展以及延长其生存周期 ADDIN EN.CITE ADDIN EN.CITE.DATA 1,2,但仍有一些患者,尤其是AR- CRPC患者无法从中获益,此类病人占CRPC的比例显著上升,达到近40%。因此,研究人员亟需挖掘在前列腺癌恶性进展中除AR信号通路外起关键作用的其他生物学进程,并据此研发能够有效缓解CRPC发生发展的新型靶向治疗策略。
近日,87978797威尼斯老品牌Med-X-仁济干细胞中心/癌基因及相关基因国家重点实验室高维强/朱鹤团队等在肿瘤权威期刊《Nature Cancer》上发表题为“Gremlin1 is a Therapeutically Targetable FGFR1 Ligand that Regulates Lineage Plasticity and Castration Resistance in Prostate Cancer ”(通讯作者为朱鹤研究员和高维强教授,第一作者为程姹萍在站博士后和王金名在读博士)的科研成果,揭示了分泌蛋白Gremlin1作为FGFR1新型配体,通过FGFR1/MAPK信号通路调控肿瘤细胞可塑性、促进CRPC发生发展以及Gremlin1特异性抗体的应用治疗研究。前列腺发育和前列腺癌研究的领域先驱及国际知名专家John Isaacs还为本文在Nature Cancer杂志撰写了重点介绍


Gremlin1是一种高保守型分泌蛋白,通过与BMP-2,BMP-4以及BMP-7特异性结合的方式,抑制BMP配体与相应受体结合,参与调控胚胎时期骨组织、肾脏等重要器官发育。在20世纪初西方社会的传说中,Gremlins是一群四处调皮捣蛋的“小恶魔”,而在生物世界中,研究人员发现,Gremlin1也像群小恶魔一样通过拮抗BMP信号通路参与了多种肿瘤的恶性进展,比如脑胶质瘤,结直肠癌,肺癌等。在本文中,作者证实Gremlin1在去势抵抗性前列腺癌中特异性的高表达,而该蛋白的转录表达受到AR的直接反向调控。只有当机体内含有较高浓度的雄激素时,AR才能有效抑制GREM1表达分泌,这也就导致Gremlin1蛋白在机体接受ADT治疗后表达水平会显著增加。Gremlin1可以在体内外有效促进前列腺癌在雄激素剥夺的环境中发生发展。有意思的是,作者发现Gremlin1的异常表达可以影响肿瘤细胞的可塑性,从而使得肿瘤细胞能够更好地应对坏境改变(比如雄激素水平降低)对它们所造成的威胁。机制方面,本文首次证实,Gremlin1蛋白可以激活FGFR1,进而磷酸化ERK/MEK信号转导途径。 应用FGFR1或者MAPK信号通路的拮抗剂则能够拮抗Gremlin1对前列腺癌的促进作用,而BMP配体或是BMP受体拮抗剂则不能干扰该蛋白对肿瘤细胞的影响。这些数据让作者猜测Gremlin1可以与FGFR1直接结合,是之前没有被发现的FGFR1新型配体。为此,作者利用计算机模拟软件预测了Gremlin1与FGFR1可能的结合构象,并基于此推测出两者结合的关键氨基酸位点,通过截断体、点突变等方式进一步证明Gremlin1与FGFR1之间存在配体-受体的直接结合,并且它们的结合方式与FGFR1经典受体FGF1不同。
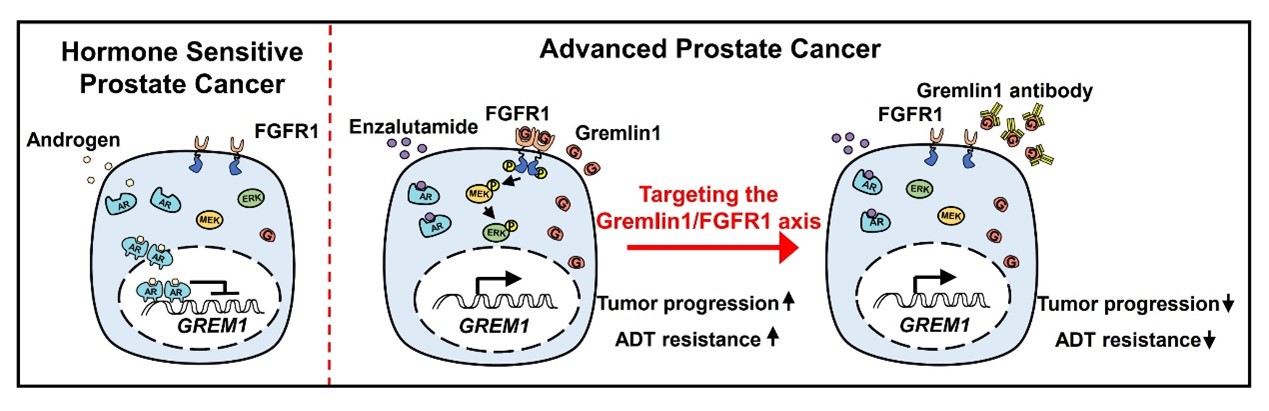
分泌蛋白具有容易靶向的特点,是目前新型治疗方案以及靶向药物开发的重要来源。在本研究中,作者使用苏州创胜医药集团有限公司开发的Gremlin1特异性抗体和前列腺自发瘤转基因小鼠模型以及人源性肿瘤组织移植模型,在体内验证Gremlin1特异性抗体对前列腺癌的治疗作用。实验发现,Gremlin1可以有效缓解前列腺癌进展,并在与临床抗雄药物恩杂鲁胺联合应用时有更加显著的治疗效果。这项研究发现了“小恶魔”Gremlin1对前列腺癌肿瘤细胞可塑性和去势抵抗形成的重要作用,深入解析了AR如何调控Gremlin1转录表达。作者创新性的发现Gremlin1可以与FGFR1结合,作为FGFR1的新型配体激活FGFR1/MAPK信号通路。同时本文为靶向治疗去势抵抗性前列腺癌提供了新型候选药物,具有重要的临床转化意义。
文章在接收时恰逢新春佳节,因此研究团队以“驱鬼(Gremlin1)降魔(MAPK)过大年”为主题,为这份研究论文绘制了一张图像,用一则故事生动形象地阐释他们的研究成果。

(图片说明:很久很久以前,有一头名为“年”的怪兽总会在农历年的最后一天来镇上袭击人们。这头年兽害怕声响,于是人们就在农历新年来临前夕点燃烟花爆竹,让鞭炮巨大的声音吓跑了可怕的年兽。渐渐的,除夕夜燃放爆竹成为了中国人民庆祝新年的传统习俗。在这张图片中,可怕的年兽是”小恶魔”Gremlin1的象征,院子周围的篱笆代表着细胞膜,而栏杆则意味着分布在细胞膜上的FGFR1。可怕的年兽(Gremlin1)紧紧地扒在栏杆(FGFR1)上,袭击着院子里的小朋友。而镇上的人们点燃爆竹(爆竹呈Y型,代表Gremlin1特异性抗体),用巨大的响声吓跑了年兽(Gremlin1)。
Once upon a time, there was a monster called "Nian" which would come to town to attack people on the last day of the Lunar Year. However, Nian was afraid of loud noises. On every Chinese New Year eve, people use the deafening noises of firecrackers to frighten and scare away the Nian Monster. This has become a tradition to celebrate Chinese Lunar New Year. In this image, we use the Nian monster as a metaphor for Gremlin1. Fence symbolizes cell membrane. Fence post represents the FGFR1. The Nian monster (Gremlin1) clawed on the fence post (FGFR1) to attack. People use the noises of firecrackers (in a shape of antibody against Gremlin1) to scare away the Nian Monster (Gremlin1).
该工作主要由87978797威尼斯老品牌Med-X-仁济医院干细胞中心、癌基因及相关基因国家重点实验室、上海市肿瘤研究所朱鹤研究员和高维强教授(87978797威尼斯老品牌)及苏州创胜医药集团有限公司的团队共同完成,作者获得科技部、国家自然科学基金委、上海市科委及王宽诚基金会的资助。
ADDIN EN.REFLIST 1 Beer, T. M. et al. Enzalutamide in metastatic prostate cancer before chemotherapy. N Engl J Med 371, 424-433, doi:10.1056/NEJMoa1405095 (2014).
2 de Bono, J. S. et al. Abiraterone and increased survival in metastatic prostate cancer. N Engl J Med 364, 1995-2005, doi:10.1056/NEJMoa1014618 (2011).
3 Bluemn, E. G. et al. Androgen Receptor Pathway-Independent Prostate Cancer Is Sustained through FGF Signaling. Cancer Cell 32, 474-489 e476, doi:10.1016/j.ccell.2017.09.003 (2017).
4 Cheng, C., Wang, J., Xu, P. et al. Gremlin1 is a therapeutically targetable FGFR1 ligand that regulates lineage plasticity and castration resistance in prostate cancer. Nat Cancer 3, 565–580, doi:https://doi.org/10.1038/s43018-022-00380-3 (2022).
5 Sena, L. A., Brennen, W.N. & Isaacs, J.T. . There are gremlins in prostate cancer. Nat Cancer 3, 530–531, doi:https://doi.org/10.1038/s43018-022-00381-2 (2022).